A proteína beta-amilóide (1-42) humana, também conhecida como Aβ 1-42, é um fator chave para desvendar os mistérios da doença de Alzheimer.Este peptídeo desempenha um papel central na formação de placas amilóides, aglomerados enigmáticos que danificam o cérebro dos pacientes com Alzheimer.Com efeito destrutivo, perturba a comunicação neuronal, desencadeia inflamação e induz neurotoxicidade, levando a comprometimento cognitivo e danos neurais.Investigar os seus mecanismos de agregação e toxicidade não é apenas vital;é uma jornada emocionante para resolver o quebra-cabeça do Alzheimer e desenvolver terapias futuras.



Aβ 1-42 é um fragmento peptídico de 42 aminoácidos que é derivado da clivagem da proteína precursora de amilóide (APP) por β- e γ-secretases.Aβ 1-42 é um dos principais componentes das placas amilóides que se acumulam no cérebro de pacientes com doença de Alzheimer, uma doença neurodegenerativa caracterizada por comprometimento cognitivo e perda de memória.Foi demonstrado que Aβ 1-42 tem várias funções e aplicações em pesquisas biológicas e biomédicas, tais como:
1.Neurotoxicidade: Aβ 1-42 pode formar oligômeros solúveis que são capazes de se ligar e interromper a função de membranas neuronais, receptores e sinapses.Esses oligômeros também podem induzir estresse oxidativo, inflamação e apoptose em neurônios, levando à perda sináptica e morte neuronal.Os oligômeros Aβ 1-42 são considerados mais neurotóxicos do que outras formas de Aβ, como Aβ 1-40, que é a forma mais abundante de Aβ no cérebro.Acredita-se também que os oligômeros Aβ 1-42 sejam capazes de se propagar de célula para célula, semelhante aos príons, e desencadear o enrolamento incorreto e a agregação de outras proteínas, como a tau, que forma emaranhados neurofibrilares na doença de Alzheimer.
Aβ 1-42 é amplamente considerada como a isoforma Aβ com maior neurotoxicidade.Vários estudos experimentais demonstraram a neurotoxicidade de Aβ 1-42 utilizando diferentes métodos e modelos.Por exemplo, Lesné et al.(Brain, 2013) investigou a formação e toxicidade de oligômeros Aβ, que são agregados solúveis de monômeros Aβ, e mostraram que os oligômeros Aβ 1-42 tiveram um efeito prejudicial mais forte nas sinapses neuronais, levando ao declínio cognitivo e à perda neuronal.Lambert et al.(Proceedings of the National Academy of Sciences, 1998) destacou a neurotoxicidade dos oligômeros Aβ 1-42 e descobriu que eles tinham um forte efeito tóxico no sistema nervoso central, possivelmente afetando sinapses e neurotransmissores.Walsh et al.(Nature, 2002) mostraram o efeito inibitório dos oligômeros Aβ 1-42 na potenciação de longo prazo (LTP) do hipocampo in vivo, que é um mecanismo celular subjacente ao aprendizado e à memória.Esta inibição foi associada ao comprometimento da memória e do aprendizado, enfatizando o impacto dos oligômeros Aβ 1-42 na plasticidade sináptica.Shankar et al.(Nature Medicine, 2008) isolou dímeros Aβ 1-42 diretamente de cérebros de Alzheimer e mostrou seu efeito na plasticidade sináptica e na memória, fornecendo evidência empírica para a neurotoxicidade dos oligômeros Aβ 1-42.
Além disso, Su et al.(Molecular & Cellular Toxicology, 2019) realizou análise transcriptômica e proteômica da neurotoxicidade induzida por Aβ 1-42 em células de neuroblastoma SH-SY5Y.Eles identificaram vários genes e proteínas que foram afetados por Aβ 1-42 em vias relacionadas ao processo apoptótico, tradução de proteínas, processo catabólico de cAMP e resposta ao estresse do retículo endoplasmático.Takeda et al.(Biological Trace Element Research, 2020) investigou o papel do Zn2+ extracelular na neurotoxicidade induzida por Aβ 1-42 na doença de Alzheimer.Eles mostraram que a toxicidade intracelular de Zn2+ induzida por Aβ 1-42 foi acelerada com o envelhecimento devido ao aumento relacionado à idade no Zn2+ extracelular.Eles sugeriram que Aβ 1-42 secretado continuamente a partir de terminais de neurônios causa declínio cognitivo relacionado à idade e neurodegeneração via desregulação intracelular de Zn2+.Estes estudos sugerem que Aβ 1-42 é um factor chave na mediação da neurotoxicidade e da progressão da doença na doença de Alzheimer, afectando vários processos moleculares e celulares no cérebro.
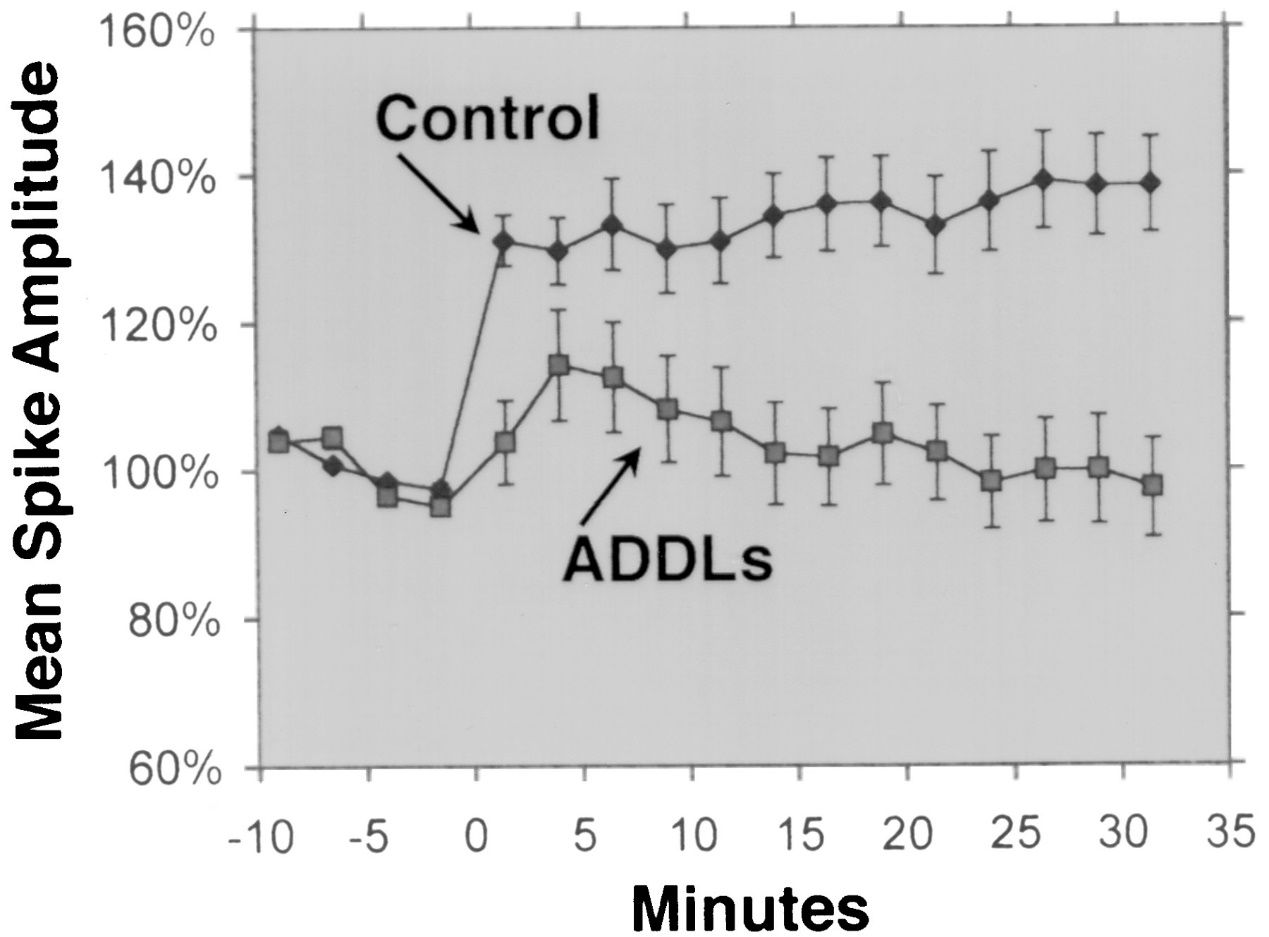
2. Atividade antimicrobiana: Foi relatado que Aβ 1-42 possui atividade antimicrobiana contra vários patógenos, como bactérias, fungos e vírus.Aβ 1-42 pode ligar-se e romper as membranas das células microbianas, levando à sua lise e morte.Aβ 1-42 também pode ativar o sistema imunológico inato e recrutar células inflamatórias para o local da infecção.Alguns estudos sugeriram que o acúmulo de Aβ no cérebro pode ser uma resposta protetora a infecções ou lesões crônicas.No entanto, a produção excessiva ou desregulada de Aβ também pode causar danos colaterais às células e tecidos hospedeiros.
Foi relatado que Aβ 1-42 exibe atividade antimicrobiana contra uma variedade de patógenos, como bactérias, fungos e vírus, como Staphylococcus aureus, Escherichia coli, Candida albicans e vírus Herpes simplex tipo 1, interagindo com suas membranas e causando sua ruptura e lise.Kumar et al.(Journal of Alzheimer's Disease, 2016) demonstrou esse efeito mostrando que Aβ 1-42 alterou a permeabilidade da membrana e a morfologia das células microbianas, levando à sua morte.Além de sua ação antimicrobiana direta, o Aβ 1-42 também pode modular a resposta imune inata e recrutar células inflamatórias para o local da infecção.Sóscia et al.(PLoS One, 2010) revelou esse papel ao relatar que Aβ 1-42 estimulou a produção de citocinas e quimiocinas pró-inflamatórias, como interleucina-6 (IL-6), fator de necrose tumoral alfa (TNF-α), monócitos proteína quimioatraente-1 (MCP-1) e proteína 1 alfa inflamatória de macrófagos (MIP-1α), em micróglia e astrócitos, as principais células imunológicas do cérebro.
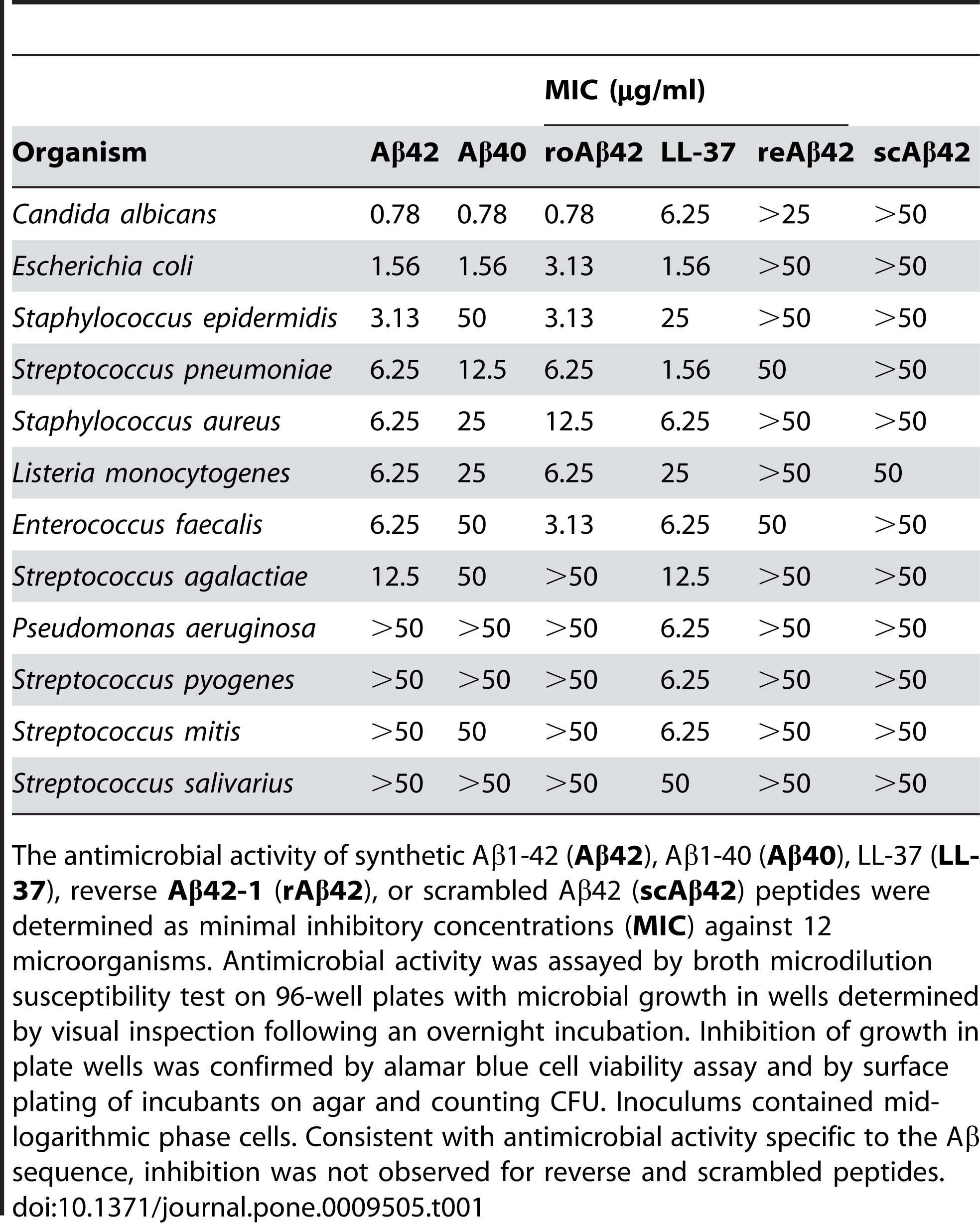
Figura 2. Os peptídeos Aβ possuem atividade antimicrobiana.
(Soscia SJ, Kirby JE, Washicosky KJ, Tucker SM, Ingelsson M, Hyman B, Burton MA, Goldstein LE, Duong S, Tanzi RE, Moir RD. A proteína beta amilóide associada à doença de Alzheimer é um peptídeo antimicrobiano. PLoS One 3 de março de 2010;5(3):e9505.)
Embora alguns estudos tenham sugerido que a acumulação de Aβ no cérebro pode ser uma resposta protectora a infecções ou lesões crónicas, uma vez que Aβ pode actuar como um péptido antimicrobiano (AMP) e eliminar potenciais agentes patogénicos, a complexa interacção entre Aβ e elementos microbianos continua a ser um problema. tema de investigação.O delicado equilíbrio é destacado pela pesquisa de Moir et al.(Journal of Alzheimer's Disease, 2018), que sugere que a produção desequilibrada ou excessiva de Aβ pode inadvertidamente danificar células e tecidos do hospedeiro, refletindo a intrincada natureza dupla dos papéis de Aβ na infecção e na neurodegeneração.A produção excessiva ou desregulada de Aβ pode levar à sua agregação e deposição no cérebro, formando oligômeros e fibrilas tóxicos que prejudicam a função neuronal e induzem neuroinflamação.Estes processos patológicos estão associados ao declínio cognitivo e à perda de memória na doença de Alzheimer, uma doença neurodegenerativa caracterizada por demência progressiva.Portanto, o equilíbrio entre os efeitos benéficos e prejudiciais da Aβ é crucial para manter a saúde do cérebro e prevenir a neurodegeneração.
3.Exportação de ferro: Foi demonstrado que Aβ 1-42 está envolvido na regulação da homeostase do ferro no cérebro.O ferro é um elemento essencial para muitos processos biológicos, mas o excesso de ferro também pode causar estresse oxidativo e neurodegeneração.Aβ 1-42 pode se ligar ao ferro e facilitar sua exportação dos neurônios via ferroportina, um transportador transmembrana de ferro.Isto pode ajudar a prevenir a acumulação de ferro e a toxicidade no cérebro, uma vez que o excesso de ferro pode causar stress oxidativo e neurodegeneração.Duce et al.(Cell, 2010) relataram que Aβ 1-42 se ligou à ferroportina e aumentou sua expressão e atividade nos neurônios, levando à redução dos níveis de ferro intracelular.Eles também mostraram que Aβ 1-42 reduziu a expressão de hepcidina, um hormônio que inibe a ferroportina, nos astrócitos, aumentando ainda mais a exportação de ferro dos neurônios.No entanto, o Aβ ligado ao ferro também pode tornar-se mais propenso à agregação e deposição no espaço extracelular, formando placas amilóides.Ayton et al.(Journal of Biological Chemistry, 2015) relatou que o ferro promoveu a formação de oligômeros e fibrilas Aβ in vitro e in vivo.Eles também mostraram que a quelação de ferro reduziu a agregação e deposição de Aβ em camundongos transgênicos.Portanto, o equilíbrio entre os efeitos benéficos e prejudiciais do Aβ 1-42 na homeostase do ferro é crucial para manter a saúde do cérebro e prevenir a neurodegeneração.
Somos um fabricante de polipeptídeos na China, com vários anos de experiência madura na produção de polipeptídeos.Hangzhou Taijia Biotech Co., Ltd. é um fabricante profissional de matérias-primas polipeptídicas, que pode fornecer dezenas de milhares de matérias-primas polipeptídicas e também pode ser personalizado de acordo com as necessidades.A qualidade dos produtos polipeptídicos é excelente e a pureza pode chegar a 98%, o que tem sido reconhecido por usuários de todo o mundo.






